Kunci Jawaban
Kunci Jawaban Kimia Kelas 12 SMA/MA, Kurikulum Merdeka, Bab 1: Ayo Berlatih Halaman 21
Inilah kunci jawaban Kimia kelas 12 SMA/MA, halaman 21, Kurikulum Merdeka. Adanya artikel ini digunakan untuk mengoreksi hasil belajar anak
Penulis: Magang TribunWow
Editor: Elfan Fajar Nugroho
TRIBUNWOW.COM - Inilah kunci jawaban Kimia Kelas 12 SMA/MA, Kurikulum Merdeka, "Ayo Berlatih" Bab 1: Larutan dan Koloid, halaman 21.
Buku ini yang ditulis oleh Galuh Yuliani, dkk diterbitkan Kementerian Pendidikan, Kebudayaan, Riset, dan Teknologi dengan nomer ISBN: ISBN 978-602-427-922-6.
Sebelum mebaca artikel pada laman in, siswa harus mengerjakan secara mandiri terlebih dahulu.
Baca juga: Kunci Jawaban Matematika Kelas 9 SMP Kurikulum Merdeka Bab 3 Hal 204-207, Transformasi Geometri
Dilansir Tribunwow.com, kunci jawaban ditulis hanya untuk membantu orang tua atau wali dalam mengoreksi hasil belajar anak.
Kunci Jawaban "Ayo Berlatih", Bab 1: Larutan dan Koloid Halaman 21
1. Tentukanlah pH dati:
a. Larutan HF 0,15 M
b. 0,77 mol hidrazin dalam 250 ml air.
c. 0,976 gram asam benzoat yang dilarutkan ke dalam 500 ml air.
d. 13,7 ml gas amonia (diukur pada suhu 27oC dan 1 atm) yang dialirkan ke dalam satu liter air. (R = 0,082 l.atm/mol.K)
Jawaban:
1. Untuk menentukan pH pada senyawa-senyawa berikut, gunakan data Ka dan Kb yang ada pada Tabel 1.2.
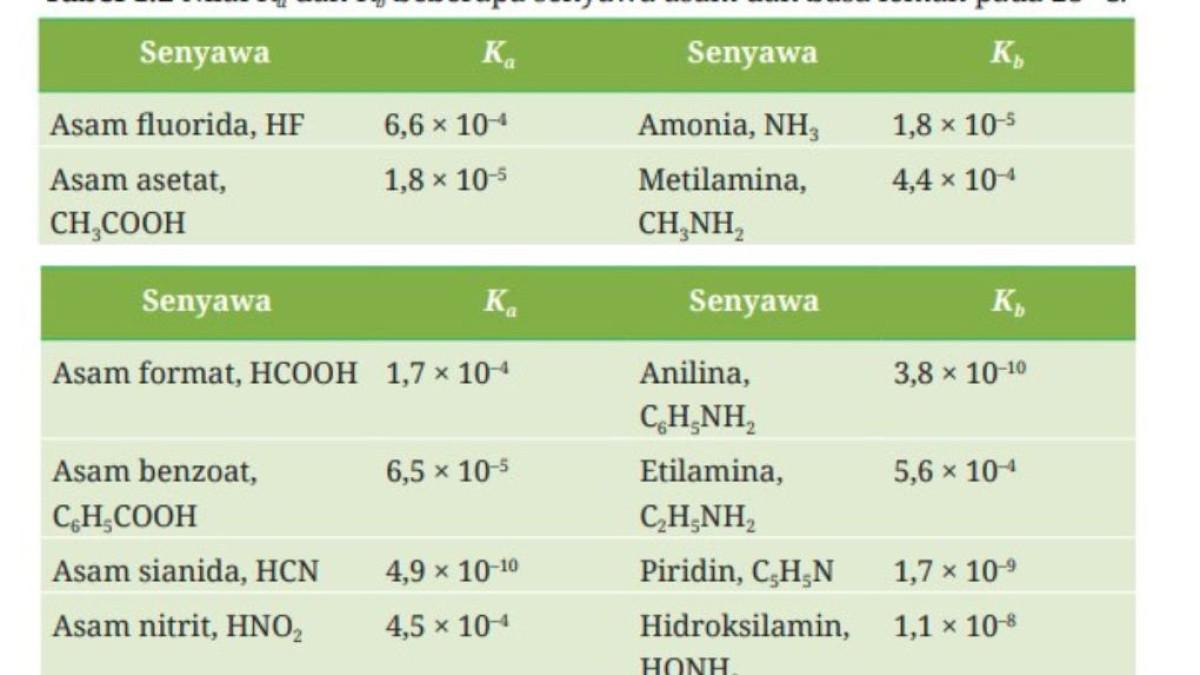
a. Larutan HF 0,15 M.
[H+] = √Ka.[HF] = √6,6 10-4.0,15 M = 1 x 10–2 M.
pH = –log 1 x 10–2 = 2.
b. 0,77 mol hidrazin dalam 250 ml air.
Hidrazin = N2H4.
[N2H4] = n / V = 0,77 mol / 0,25 l = 3,08 M.
[OH–] = √Kb.[N2H4] = √1,3 10-6.3,08 M = 2 x 10–3 M.
pOH = –log 2 x 10–3 M = 3 – log 2
pH = 14 – (3 – log 2) = 11 + log 2
c. 0,976 gram asam benzoat yang dilarutkan ke dalam 500 ml air.
Asam benzoat = C6H5COOH.
Mm asam benzoat = Mm ((7.C) + (6. H) + (2. O)) = (7.12) + (6.1) + (2. 16) g/mol = 122 g/mol.
n asam benzoat = m / Mm = 0,976 g / 122 g/mol = 0,008 mol.
[asam benzoat] = n / V = 0,008 mol / 0,5 l = 0,016 M.
[H+] = √Ka.[asam benzoat] = √6,5 x 10-5 .0,016 M = 1 x 10–3 M.
pH = –log 1 x 10–3 M = 3
d. Sebanyak 13,7 ml gas amonia (diukur pada suhu 27 oC dan
1 atm) dialirkan ke dalam satu liter air. (R = 0,082 l.atm/mol.K)
n amonia = PV / RT = 1 atm .13,7 ml / 0,082 l.atm/mol.K .300 K = 0,56 mmol
[amonia] = n / V = 0,56 mmol / 1 l = 0,56 mM = 5,6 x 10–4 M.
[OH–] = √Kb.[NH3] = √1,8 x 10-5.5,6 10-4 M = 1 x 10–4 M.
pOH = –log 1 x 10–4 M = 4.
pH = 14 – 4 = 10.
2. Dengan menggunakan Tabel 1.2, urutkanlah asam-asam lemah tersebut dari asam terkuat menuju asam terlemah.

Jawaban:
HF > HNO2 > HCOOH > C6H5COOH > CH3COOH > HCN > C6H5OH.
3. Dengan menggunakan Tabel 1.2 juga, urutkanlah basa lemah berdasarkan kenaikan kekuatan basanya!
Jawaban:
C6H5NH2 < C5H5N>
4. Asam cuka makan yang dijual di pasar memiliki kadar asam asetat, CH3COOH, sebanyak 25 persen. Apabila massa jenis cuka tersebut dianggap 1,2 g/ml, maka hitung pH larutan asam cuka tersebut!
Jawaban:
Massa larutan cuka diasumsikan sebesar 100 g untuk mempermudah perhitungan.
Massa asam asetat dalam larutan dihitung menggunakan persentase kadar:
Massa CH3COOH = 25 / 100 × 100 g = 25 g
Perhitungan Volume Larutan:
Volume larutan = Massa larutan / Massa jenis =100 g / 1.2 g/ml = 83.33 ml.
Volume larutan dikonversi ke liter:
Volume larutan = 83.33 ml × 1 L / 1000 ml = 0.08333 L
Perhitungan Mol Asam Asetat
Massa molar (Mr) asam asetat (CH3COOH) dihitung:
Mr = (2 × Ar C) + (4 × Ar H) + (2 × Ar O) = (2 × 12) + (4 × 1) +(2 × 16) = 24 + 4 + 32 = 60 g/mol.
Mol asam asetat dihitung:
Mol CH3COOH = Massa CH3COOH / Mr CH3COOH = 25 g / 60g/mol = 0.4167 mol.
Baca juga: Kunci Jawaban Fisika Kelas 12 SMA/MA, Kurikulum Merdeka, Bab 2: Arus Searah
Perhitungan Konsentrasi Asam Asetat
Konsentrasi molar (M) asam asetat dihitung:
M = Mol CH3COOH / Volume larutan = 0.4167 mol / 0.08333 L = 5.00 M.
Perhitungan Konsentrasi Ion Hidrogen
Konsentrasi ion hidrogen ( [H+]) dihitung menggunakan rumus asam lemah:
[H+] = √Ka × M. Diasumsikan nilai Ka asam asetat adalah 1.8 × 10-5.
[H+] = √1.8 × 10-5 × 5.00 = √9.0 × 10-5 = 9.48 × 10-3 M.
Perhitungan pH
pH = −log[H+] = −log (9.48 × 10-3) = 2.02.
Maka pH larutannya adalah 2.02.
*) Disclaimer :
Jawaban di atas hanya digunakan untuk memandu orang tua dalam proses belajar anak.
Sebelum menyimak artikel ini, pastikan anak sudah mengerjakannya secara mandiri terlebih dahulu.
Gunakanlah artikel ini hanya untuk mengoreksi dan mengawasi hasil belajar anak.
(TribunWow.com/Peserta Magang dari Universitas Sebelas Maret/Mareta Galuh Ayuningtyas)
| Kunci Jawaban Matematika Kelas 5 SD/MI: Uji Kompetensi Bab 8, Halaman 269-272, Kurikulum Merdeka |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/KUNCI-JAWABAN-Matematika-Kelas-5-SDMI-Ayo-Berlatih-Halaman-277.jpg)
|
|---|
| Kunci Jawaban Matematika Kelas 5 SD/MI Kurikulum Merdeka: Ayo Berdiskusi, Bab 9, Halaman 291 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/Buku-Matematika-Kelas-5-SDMI.jpg)
|
|---|
| Kunci Jawaban Matematika Kelas 5 SD/MI Kurikulum Merdeka: Ayo Berdiskusi, Bab 8, Halaman 251 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/KUNCI-JAWABAN-Matematika-Kelas-5-SDMI-Ayo-Berlatih-Halaman-277.jpg)
|
|---|
| Kunci Jawaban Animasi Kelas 10 SMK/MAK Uji Kompetensi Bab 7 Kurikulum Merdeka Halaman 197 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/animasi-bab-7.jpg)
|
|---|
| Kunci Jawaban Animasi Kelas 10 SMK/MAK Uji Kompetensi Bab 6 Kurikulum Merdeka Halaman 178 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/animasi-bab-6-kelas-10.jpg)
|
|---|
:quality(30):format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/KUNCI-JAWABAN-Kimia-Kelas-12-SMAMA-Ayo-Berlatih-Bab-1-Halaman-21-Kurikulum-Merdeka.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/Hana-Maulida-dan-Kakak-Aman-Indonesia-2.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/suku-anak-dalam-jambi.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/Penandatanganan-Kerjasama-Indonesia-dan-Vatikan.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/rumah-ahmad-sahroni-dibongkar.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/pramono-anungg.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/cover-bab-2-ekonmi-kls10.jpg)