Kunci Jawaban
Kunci Jawaban Kimia Kelas 11 SMA Kurikulum Merdeka Cek Pemahaman Bab 2 Halaman 60 61 62
Simak kunci jawaban Kimia Kelas 11 SMA Kurikulum Merdeka, cek pemahaman Bab 2 tentang Ikatan Kimia halaman 60, 61, 62.
Penulis: ElfanNugg
Editor: Lailatun Niqmah
TRIBUNWOW.COM - Simak kunci jawaban Kimia Kelas 11 SMA Kurikulum Merdeka Cek Pemahaman Bab 2 tentang Ikatan Kimia halaman 60-62.
Soal ini terdapat pada buku Kimia kelas 11 SMA Kurikulum Merdeka Bab 2, tentang Ikatan Kimia.
Buku Kimia ini ditulis oleh Munasprianto Ramli dan Nanda Saridewi.
Soal ini berupa lima pilihan ganda dan tiga uraian.
Baca juga: Cek Kunci Jawaban Sejarah Kelas 11 SMA Kurikulum Merdeka Bab 3 Halaman 46-47, Kolonialisme
Dalam pembelajaran Kimia kelas 11 SMA Bab 2 Kurikulum Merdeka, siswa diharapkan mampu membedakan proses pembentukan ikatan ion dan kovalen dan menjelaskan ikatan logam.
Kunci jawaban ini dapat digunakan orang tua atau wali untuk mengoreksi hasil belajar anak.
Sebelum melihat hasil kunci jawaban, pastikan siswa terlebih dahulu mengerjakan sendiri soal yang disiapkan.
Baca juga: Cek Kunci Jawaban Sejarah Kelas 11 SMA Kurikulum Merdeka Bab 3 Halaman 46-47, Kolonialisme
Pilihan Ganda
1. Diketahui atom 19X dan 8Y.
Maka atom X dan Y akan membentuk senyawa yang ….
a. Berikatan ion dengan rumus kimia XY
b. Berikatan ion dengan rumus kimia X2Y
c. Berikatan ion dengan rumus kimia XY2
d. Berikatan kovalen dengan rumus kimia X2Y
e. Berikatan kovalen dengan rumus kimia XY2

Jawaban : B
2. Di bawah ini merupakan sifat-sifat senyawa ion, kecuali ….
a. Bersifat keras dan rapuh
b. Mudah larut dalam air
c. Memiliki titik leleh dan titik didih yang tinggi
d. Padatannya dapat menghantarkan arus listrik
e. Larutannya dapat menghantarkan arus listrik
Jawaban : D
3. Diketahui senyawa-senyawa berikut.

Senyawa yang jenis gaya antarmolekulnya termasuk ke dalam dipol-dipol permanen adalah ….
a. (1) dan (2)
b. (1) dan (3)
c. (1) dan (5)
d. (2) dan (4)
e. (4) dan (5)
Jawaban : C
4. XeF4 memiliki bentuk molekul dan hibridisasi …

Jawaban : B
Pembahasan Nomor 4
Bentuk molekul dan hibridisasi dari XeF4 dapat ditentukan dengan cara sebagai berikut.
Elektron valensi Xe = 8 elektron
Elektron dari 4 atom F = 4 elektron
Jumlah elektron di sekitar atom pusat = 12 elektron
Jumlah pasangan elektron di sekitar atom pusat = 6 pasang
Jumlah pasangan elektron terikat = 4 pasang
Jumlah pasangan elektron bebas = 2 pasang
Enam pasang elektron di sekitar atom pusat menghasilkan geometri pasangan elektron oktahedral.
Namun, dua pasang elektron bebas pada atom pusat menyebabkan tolak-menolak sejauh mungkin antara pasangan elektron bebas dengan pasangan elektron ikatan.
Hal ini menyebabkan geometri molekul XeF4 menjadi segi empat datar.
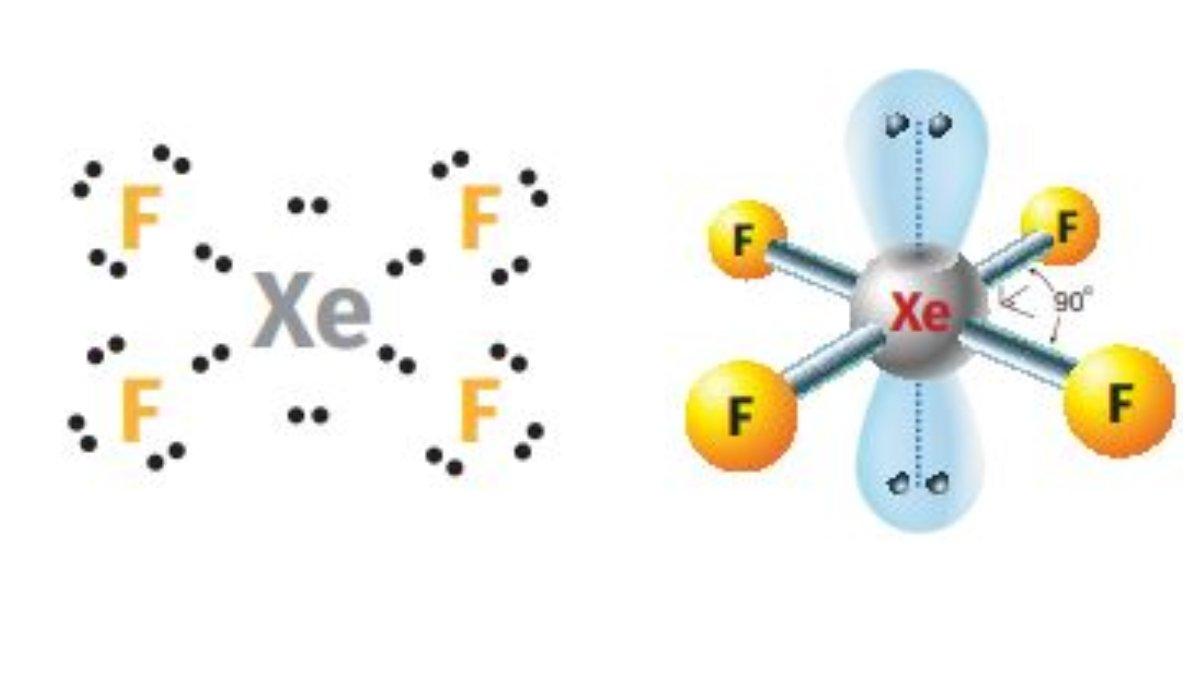
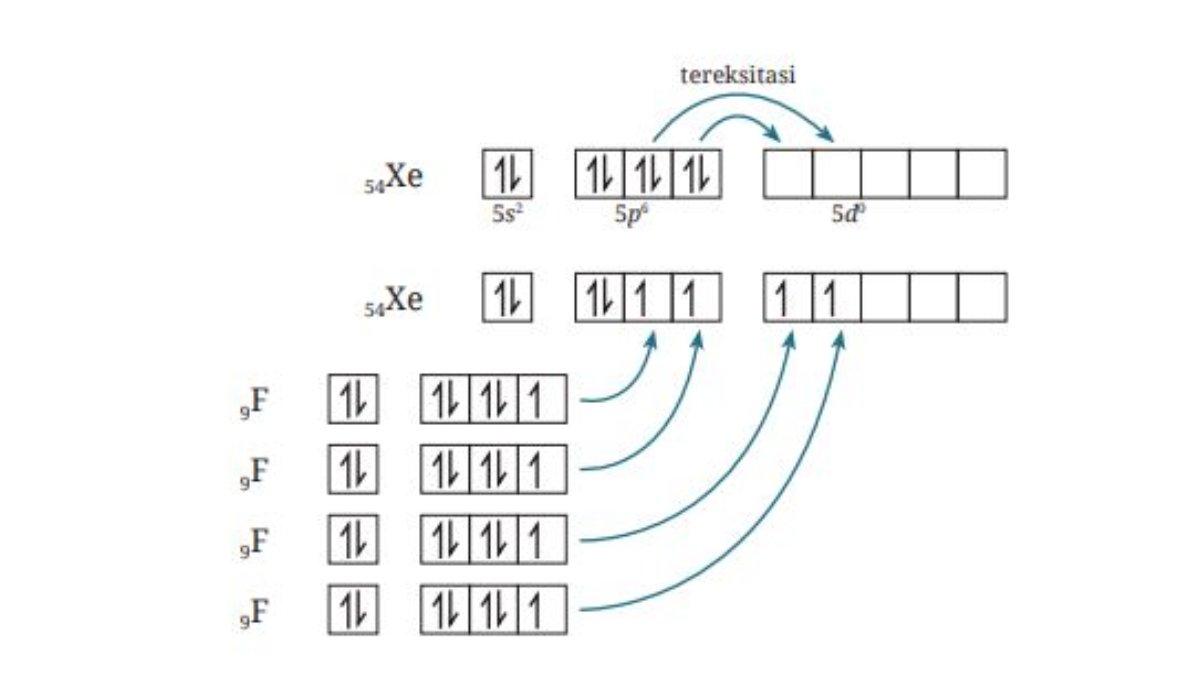
Xenon merupakan unsur gas mulia yang sudah stabil.
Namun, karena elektron valensi xenon berada pada kulit kelima dalam golongan VIIIA maka xenon memiliki orbital d yang kosong.
Orbital kosong ini dapat digunakan sebagai orbital hibrida untuk terbentuknya ikatan antara atom xenon dan empat atom luorin.
Hibridisasi XeF4 adalah sp pangkat 3 d pangkat 2 (terdapat enam orbital hibrida, dua orbital dipakai untuk pasangan elektron bebas, empat orbital dipakai untuk pasangan elektron ikatan).
5. Di antara molekul berikut

Yang merupakan molekul polar adalah ….
a. (1) dan (2)
b. (1) dan (3)
c. (1) dan (5)
d. (2) dan (4)
e. (3) dan (5)
Jawaban : B
Uraian
1. Emas merupakan salah satu unsur logam mulia.
Sifat mulia ini karena unsur emas bersifat stabil (tidak mudah bereaksi).
Karena nilai komersial dan kilapnya yang menarik maka emas banyak digunakan sebagai perhiasan.
Kadar emas di dalam perhiasan umumnya disebut dengan karat, seperti emas 24 karat, 23 karat, 22 karat, dan seterusnya.
Berkurangnya nilai karat ini menandakan bertambahnya jumlah unsur logam lain selain emas yang ditambahkan untuk membuat campuran perhiasan emas tersebut.
Semakin kecil nilai karatnya biasanya akan menghasilkan perhiasan dengan bentuk yang lebih variatif dibandingkan emas 24 karat.
Mengapa demikian?
Jawaban Soal Nomor 1 :
Karat emas berkurang dikarenakan adanya penambahan logam lain pada campuran logam emas tersebut.
Biasanya toko emas menambahkan logam lain sehingga kadar emasnya tidak 100 persen.
Emas 22 karat terdiri atas 91,6 persen logam emas (Au) dan 8,3 persen logam perak (Ag).
Penambahan logam lain ini mengakibatkan kerapatan atom-atom penyusun logam menjadi berkurang karena perbedaan jari-jari atom dari dua unsur yang berbeda.
Hal memberikan keuntungan karena emas menjadi mudah dibentuk sehingga emas 22 karat memiliki bentuk perhiasan yang lebih bervariasi dibandingkan emas 24 karat.
2. Gas hidrogen merupakan salah satu bahan bakar alternatif yang ramah lingkungan.
Negara Jepang telah lama mengembangkan kendaraan berbahan bakar hirogen untuk mengurangi emisi gas berbahaya kendaraan bermotor.
Jika menggunakan hidrogen maka emisinya berupa H2O, bukan CO2 dan CO yang dihasilkan dari bahan bakar hidrokarbon.
Namun, gas hidrogen merupakan gas yang sangat reaktif dan mudah meledak sehingga lebih aman disimpan dalam wujud cair pada stasiun pengisian bahan bakar.
Bagaimanakah gaya antarmolekul yang terjadi pada hidrogen sehingga dapat berwujud cair?
Jawaban Soal Nomor 2 :
Molekul hidrogen merupakan molekul polar.
Gaya van der Waals yang dapat terjadi antara molekul nonpolar dengan molekul nonpolar adalah gaya dipol sesaat atau gaya London.
Akibat adanya gaya dipol sesaat ini maka hidrogen dapat berubah menjadi fase cair.
Namun, karena hanya sesaat dan bersifat lemah maka hidrogen cair dapat segera berubah menjadi hidrogen fase gas pada ruang terbuka.
3. Atom sulfur dapat berikatan kovalen dengan atom F dan memenuhi kaidah oktet untuk membentuk molekul SF2.
Lebih lanjut, atom sulfur juga dapat membentuk molekul SF4 dan SF6 yang stabil meskipun tidak memenuhi kaidah oktet.
Meskipun memiliki atom pusat dan atom terikat yang sama, molekul SF2 bersifat polar, sementara molekul SF6 bersifat nonpolar.
Mengapa ini dapat terjadi ?
Jawaban Soal Nomor 3 :
SF2 memiliki geometri pasangan elektron tetrahedral.
Namun, adanya pasangan elektron bebas menyebabkan bentuk molekulnya menjadi bengkok.
Akibatnya, SF2 memiliki momen dipol yang tidak nol sehingga bersifat polar.
Sementara, SF6 memiliki geometri pasangan ikatan oktahedral.
Karena tidak ada pasangan elektron bebas maka semua pasangan elektron tersebut dipakai untuk berikatan sehingga bentuk molekulnya tetap oktahedral.
Semua ikatannya saling meniadakan sehingga momen dipolnya sama dengan nol.
Hal inilah yang menyebabkan SF6 bersifat nonpolar.
*) Disclaimer :
Jawaban di atas hanya digunakan untuk memandu proses belajar anak.
Sebelum melihat kunci jawaban, pastikan siswa mengerjakan sendiri terlebih dahulu soal-soal di atas.
(Magang TribunWow.com/Marita Nur Isnawati)
Baca Berita Menarik Lainnya di Google News.
Sumber: TribunWow.com
| Kunci Jawaban Buku PAI dan Budi Pekerti Kelas 9 SMP/MTS Kurikulum Merdeka Bab 9 Halaman 196-198 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/Buku-Pendidikan-Agama-Islam-Dan-Budi-Pekerti-Kelas-9-SMPMTS.jpg)
|
|---|
| Kunci Jawaban Matematika Kelas 5 SD/MI: Ayo Berlatih Bab 2, Halaman 52-53, Kurikulum Merdeka |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/KUNCI-JAWABAN-Matematika-Kelas-5-SDMI-Ayo-Berlatih-Bab-2-Halaman-42.jpg)
|
|---|
| Kunci Jawaban Animasi Kelas 12 SMK/MAK Uji Kompetensi Bab 2 Kurikulum Merdeka Halaman 165 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/ANIMASI-2.jpg)
|
|---|
| Kunci Jawaban Informatika Kelas 7 SMP/MTs Bab 3 Halaman 131 Uji Kompetensi Nomor 1-8 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/info.jpg)
|
|---|
| Kunci Jawaban Buku PAI dan Budi Pekerti Kelas 9 SMP/MTS Kurikulum Merdeka Bab 6 Halaman 130-132 |
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/Buku-PAI-dan-Budi-Pekerti-untuk-kelas-9-SMPMTS-Kurikulum-Merdeka-Bab-6.jpg)
|
|---|
:quality(30):format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/Buku-Kimia-Kelas-11-SMA-Kurikulum-Merdeka.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/sampul-perhotelan.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/PRAKIRAAN-CUACA-Foto-hujan-yang-mengguyur-area-kantor-Tribun-Network-di-Klodran-Colomadu.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/rumah-ahmad-sahroni-dibongkar.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/pramono-anungg.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/cover-bab-2-ekonmi-kls10.jpg)
:format(webp):focal(0.5x0.5:0.5x0.5)/wow/foto/bank/originals/ilustrasi-polisi-baru.jpg)